ガラクト脂質
~実はみなさん、たくさん食べてます~
植物の膜を構成する脂質
大腸菌でも酵母でもヒトの細胞でもそうですが、生体膜の脂質二重層は主に リン脂質で作られています。それに対し、植物の葉に最も多く含まれる膜脂質は、ガラクト脂質と呼ばれる糖脂質です。植物の葉の細胞にはとても多くの 葉緑体が詰まっており、また葉緑体の中には幾重にも重なったチラコイド膜が詰まっていて、さらにチラコイド膜の脂質二重層のほとんどがガラクト脂質でできているので、結局、植物の葉っぱにはガラクト脂質が膜脂質成分としては最も多く含まれていることになります。ほうれん草の葉っぱを食べてもまったく脂っぽくは感じませんが、実はある程度の量の脂質を摂っていることになります(マグロの大トロや霜降り牛肉を食べるのに比べればほんとに微々たるものですが)。
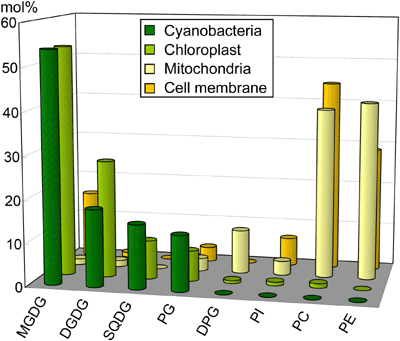
図1. シアノバクテリアと高等植物のオルガネラにおける脂質組成の比較
MGDG, モノガラクトシルジアシルグリセロール;
DGDG, ジガラクトシルジアシルグリセロール;
SQDG, スルホキノボシルジアシルグリセロール;
PG, ホスファチジルグリセロール;
DPG, ジホスファチジルグリセロール;
PI, ホスファチジルイノシトール;
PC, ホスファチジルコリン;
PE, ホスファチジルエタノールアミン.
(小林康一 光合成研究 2009 19: 52-58より改変)
さて、このガラクト脂質、チラコイド膜脂質の主成分で植物に多量に含まれているにもかかわらず、生物の世界全体で見ると意外と珍しい類の脂質で、これほどたくさん使っているのは実は植物(藻類を含む)の葉緑体と シアノバクテリアくらいなのです。実際、植物細胞でも、葉緑体以外の生体膜は動物と同様、主にリン脂質で構成されています(図1)。葉緑体の祖先は植物細胞に取り込まれたシアノバクテリアだと言われていますから( 細胞内共生説)、この葉緑体に特徴的なガラクト脂質も細胞内共生の際に植物細胞にもたらされたのではないかと考えられています。実際、葉緑体とシアノバクテリアでは膜脂質組成が非常に良く似ており(図1)、この仮説を支持しています。
ガラクト脂質は植物とシアノバクテリアに特有の脂質ですが、その構造はとてもシンプルです(図2)。疎水性尾部であるジアシルグリセロール(DAG)に親水性頭部として1分子のガラクトースが結合したものをモノガラクトシルジアシルグリセロール(MGDG)、2分子のガラクトースが結合したものをジガラクトシルジアシルグリセロール(DGDG)といいます。

図2. ガラクト脂質の構造
R1, R2; 脂肪酸基
高等植物の場合、脂肪酸は主に16:0, 16:3, 18:2, 18:3等で構成される。
ガラクト脂質の合成経路
さて、細胞内共生説に基づけば、葉緑体とシアノバクテリアは遠い親戚のような関係です。実際、チラコイド膜の脂質組成の類似性もそれを示唆しています。一方で、面白いことに、ガラクト脂質の合成経路においては、両者は大きな違いをみせます(図3)。シアノバクテリアではUDP-グルコースを使ったDAGへの糖転移反応がまず起こり、結果としてモノグルコシルジアシルグリセロール(MGlcDG)が作られます。その後、グルコースからガラクトースへの異性化反応がDAG上で行われ、最終的にMGDGが作られます[1]。それに対し、葉緑体型の酵素はUDP-ガラクトースを用いるため、一段階の反応でMGDGが合成されます[2]。
そのため、両者では、これらの反応を担う酵素もまったく別物となっています。特に興味深い点としては、シアノバクテリアでは一旦MGlcDGができるにもかかわらず、さらにそれをMGDGへと変換するということです。すなわち、このことは、極性頭部がグルコースでは何か都合が悪いことがあり、そこはガラクトースである必要がある、ということを示唆しています。立体構造上の違いが重要なのではないかと予想されていますが、その詳細は全く分かっていません。

図3. シアノバクテリアと葉緑体における
MGDG合成経路の違い
FA, 脂肪酸;
Glc, グルコース;
Gal, ガラクトース.
植物では、これらガラクト脂質の合成反応は葉緑体の包膜で行われます(図4)。まず、DAGとUDP-ガラクトースを材料にMGDGが作られます。この反応は、MGDG合成酵素(MGD:EC 2.4.1.46)によって触媒されます[2]。
DGDGはMGDGにさらにもう一つガラクトースが付加されることで合成されます。シロイヌナズナでは、ほとんどのDGDGがUDP-ガラクトースを用いた反応によって合成され、この反応はDGDG合成酵素(DGD:EC 2.4.1.241)によって触媒されます[3]。

図4. 高等植物における
ガラクト脂質合成経路
さらに最近、2分子のMGDGからDGDGを合成する酵素がシロイヌナズナにおいて新たに発見されました[4]。この酵素のDGDG合成全体に占める寄与は小さいのですが、植物の低温耐性に関与する重要な酵素として注目を浴びています。
MGDG合成酵素
MGDGは地球上で最も多く存在する極性脂質であると言われており、この脂質の生合成を担う酵素は早くから注目されていました。しかし、この酵素は活性が取りづらいうえに、植物体におけるタンパク質含量も少ないことから単離・同定は困難を極め、複数の研究グループによる努力にもかかわらず、その正体は長らくベールに包まれていました。
しかしそのような状況の中、1990年代後半に入ったところで、 太田らのグループ によりついにこの酵素の正体が明らかにされました[2]。
彼らは比活性の高いキュウリ子葉を用いてこの酵素の精製に成功しましたが、その精製には凄まじい量のキュウリ子葉を費やしたとのことです。さて、こうして酵素が単離されそのアミノ酸配列が明らかにされると、遺伝子解析技術の進歩やシロイヌナズナゲノムプロジェクトの進展に伴い、 MGDG合成酵素遺伝子の研究も急速に発展し、さらにはDGDG合成酵素遺伝子の同定にもつながっていきました。特に、モデル植物のシロイヌナズナにおける解析から色々なことが分かってきました。

図5. 高等植物におけるMGDG合成酵素の分布
高等植物におけるMGDG合成酵素はアミノ酸配列からAタイプとBタイプのサブファミリーに分けられる。 AタイプはN末端に葉緑体移行シグナルを持つが、Bタイプは明確なシグナルペプチドを持っていない。
シロイヌナズナにはMGD1, MGD2, MGD3の3種のMGDG合成酵素が存在しています。これらはアミノ酸の相同性から、Aタイプ(MGD1)とBタイプ(MGD2, MGD3)に分類することができます(図5)[5]。
AタイプとBタイプは様々な点において興味深い違いを示します。まず細胞内局在については、AタイプのMGD1タンパク質が葉緑体内包膜にあるのに対し、 BタイプのMGD2/3は外包膜に局在することが分かっています。遺伝子発現パターンも大きく異なっており、MGD1が様々な組織、特に光合成を行う緑色組織で強い発現を示すのに対し、通常MGD2/3の発現は緑色組織ではほとんど見られません(図6)。ただ面白いことに、MGD2/3は花粉の発達や花粉管伸長時に強い発現を示します[6]。
ユリ花粉を用いた実験から、実際に花粉管伸長時にはガラクト脂質が多く作られることが明らかとなりましたが、その役割はまだ分かっていません[7]。

図6. シロイヌナズナMGDG合成酵素遺伝子の発現
青く染まっている部分(MGD promoter-GUSの発現)がそれぞれの遺伝子の発現部位を示す。
葉ではMGD1が主に発現しているという事実から予想されるように、チラコイド膜構築に使われるガラクト脂質のほとんどはMGD1を介して合成されます。実際、MGD1の機能を完全に欠いた変異体(ノックアウト変異体)はガラクト脂質をほとんど持たず、またチラコイド膜も完全に失ってしまっています。そのため、この変異体はアルビノで光合成活性を持たず、発芽しても矮小のまま死んでしまいます(図7)[8]。

図7. シロイヌナズナMGD1ノックアウト変異体
MGD1ノックアウト変異体(mgd1-2)は、培地に糖がある場合のみ発芽するが、緑化できず、ほとんど育たつこと無く死んでしまう。
その一方で、MGD2とMGD3については、両者を欠損した二重変異体においても、栄養が十分な生育条件下では何も変わったところを見せないことから[9]、その条件で生育する分にはほとんど必要がないと言うことができます。しかし、本当にこれらのBタイプMGD酵素は植物に必要無いのでしょうか?というのも、このBタイプサブファミリーは種子植物の進化の過程で、長い間失われずに保存されてきたからです(図5)。この事実は、Bタイプサブファミリーが植物にとって必要である(あった)可能性を示しています。
さて、この疑問に対する答えは、植物が独自に発達させてきたガラクト脂質の意外な役割にありました。
植物は動物のように自由に移動できないので、生育環境の良し悪しはその植物の運命を大きく左右します。例えば、風に運ばれ種がたどり着いた先が、三大栄養素であるリンをほとんど含まない土壌だったとしたら、どうでしょう?ちょっと運が悪かったと、植物は歩いて別の場所へ移動することはできないので、その環境に適応して生きていくしかありません。リンはDNA, RNAなどの核酸の必須構成要素であり、またエネルギーの貯蔵やタンパク質の修飾などにも使われる、すべての生命にとって必要不可欠な元素です。無いのだからしょうがない、などとは言ってられません。さらにリン脂質として生体膜の構築にも大量のリンが使われます。しかし、もしこのリン脂質を他の膜脂質で代替できれば、その分多くのリンを他の生体反応に転用することができそうです。そこで植物は、リン元素を含まないガラクト脂質をリン脂質の代わりに使うことを始めました。その時活躍するのがBタイプMGDG合成酵素です。
植物をリン欠乏条件下へ持っていくと、ガラクト脂質合成が強く活性化され、結果としてDGDGが多量に合成されます。シロイヌナズナ細胞のミトコンドリアでは、リン欠乏時には膜脂質の20%弱がDGDGで占められるほか[10]、オートムギではなんと、リン欠乏により細胞膜の約70%がDGDGに置き換わる、という報告もあります[11]。
このとき、遺伝子レベルでは、リン脂質分解酵素(ホスホリパーゼ)遺伝子の誘導と共に、 DGDG合成酵素遺伝子の発現が活性化されます[12]。 DGDG合成にはMGDGが基質として必要なので、MGDG合成も活性化されますが、この時はAタイプのMGD1では無く、BタイプのMGD2/3の遺伝子発現が強く誘導されます。これら脂質代謝系遺伝子の協調的な働きによって、結果としてリン脂質からDGDGへの転換が行われます。
このようにリン欠乏時にはMGDG合成とDGDG合成の両方が活性化されますが、実際にはDGDGの含量しか増加しません。このことは、リン欠乏時にBタイプMGDによって合成されるMGDGは、軒並みDGDGの合成に使われるということを示しています。このとき合成されたDGDGは、主に細胞膜やミトコンドリア膜などの葉緑体外の膜に運ばれ、リン脂質の代わりをしていると考えられています。実際、この代替機構が部分的に働くなったmgd2mgd3二重変異体では、リン欠乏条件下での植物の生育が阻害されることが分かっており[9]、植物にとってのこのシステムの重要性が窺えます。実験室では、通常十分な栄養を与えて植物を育てますが、本来の自然環境では、ほとんどの土地が”実験室で言う”リン欠乏条件となっていることから(リン元素自体は豊富でも、植物が利用しづらい化合物を形成している)、この膜転換システムは、植物にとって重要な生き残り戦略の一つとして機能しているのでしょう。
以上のことから、BタイプMGDサブファミリーは高等植物のリン欠乏適応機構の発展と共に進化、保持されてきたと考えられます。
これまでの話をまとめますと、シロイヌナズナのMGDG合成経路にはAタイプMGD1による内包膜経路と BタイプMGD2/3による外包膜経路があります(図8)[13]。内包膜経路は、チラコイド膜構築にガラクト脂質を供給する役割を担っており、葉緑体の発達に必須の経路となっています。それに対し、外包膜経路は、主に葉緑体外にDGDGを供給する経路と考えられ、リン欠乏時にはこの経路が活性化し、さまざまな膜でリン脂質の代替をしていると考えられます。つまり、外包膜経路は、太古の昔に細胞内共生で得たであろうガラクト脂質を、本来の仕事場である葉緑体膜だけでなく、その他の膜にも利用するために獲得した経路、ということができるかもしれません。
 図8. シロイヌナズナ細胞内におけるMGDG合成経路
図8. シロイヌナズナ細胞内におけるMGDG合成経路
MGDGとDGDG
さて、リン欠乏時にはリン脂質の代替をDGDGが行うという話を書きましたが、なぜMGDGではなくDGDGなのでしょう。実際、リン欠乏条件下ではMGDG合成活性も上昇するのですが、上述したように、MGDG量の増加はほとんど観察されません。
その答えは、MGDGとDGDGの構造上の違いにあります。
MGDGの極性頭部はガラクトース1分子のみで構成されており、2分子の長鎖不飽和脂肪酸で構成される疎水性尾部と比して占める体積が小さいため、円錐状の構造をとります。この円錐状の構造を持つ脂質は単独で脂質二重層を形成するのが不得意なため、ノンラメラ脂質と呼ばれます。それに対し、DGDGはガラクトース2分子で極性頭部を構成するので、円柱状の構造をしています。円柱状の構造を持つ脂質は単独で脂質二重層を形成できるため、ラメラ脂質と呼ばれます[14]。葉緑体膜以外の生体膜では、この円柱状構造を持つホスファチジルコリン(PC)が大きな割合を占めていることから、同じラメラ脂質として構造的性質が近いDGDGの方が代替脂質としてより適切なのだと考えられます。
また、この構造的性質から考えてみると、チラコイド膜はノンラメラ脂質であるMGDGを50%も含む、とてもユニークな膜系だということができます。MGDGは単独では脂質二重層を形成できませんが、チラコイド膜に多く含まれる光アンテナ複合体タンパク質と相互作用することで層状の構造を作るという報告もあり[15]、この脂質の特性がチラコイド膜独特の構造を形成するのに必要であると推測されています。
一般的にチラコイド膜ではMGDG:DGDGが2:1の割合で存在しており、この割合が理想的な光合成活性に重要であるといわれていますが、近年の研究から、様々なストレスに応答してこの比率が変わることが示されています。特に低温環境下では、このガラクト脂質構成を変えることが植物の生育に必須であることが明らかにされており[4]、今後さらなる研究の発展が期待されます。
最後に、なぜシアノバクテリアや葉緑体はガラクト脂質をこれほどまで大量に使っているか、という疑問について考察してみます。葉緑体はシアノバクテリアを祖先に持っているので、シアノバクテリアの視点に立って考えてみます。
前の章で、自然環境ではリンは不足しがちなことを述べましたが、それはシアノバクテリアにとっても同様です。本来シアノバクテリアの住む海や湖では利用可能なリンの濃度は低く、増殖の制限要因の一つになっています[16]。このことは、生活排水(リン系化合物を多く含む)で汚染された川や湖では、水の富栄養化[WP] によりシアノバクテリアの異常発生がたびたび起こることからも窺えます。
さて、シアノバクテリアは非常に高度に発達した膜系、いわゆるチラコイド膜を内部に大量に保持しており、これが光合成を行うのに必要不可欠なわけですが、これをもしリン脂質で作るとなると、大量のリン元素が必要となります。自然界には利用可能なリンが少ないにも関わらず、です。そこで、シアノバクテリアはガラクト脂質を用いることで、リン元素を使うこと無しにあれほど大量のチラコイド膜を構築することに成功したのではないか、ということが一つの可能性として考えられます。
最後に余談ですが、そんな中で、シアノバクテリアは唯一、ホスファチジルグリセロール(PG)というリン脂質をチラコイド膜に使っています。その割合はそれほど多くないにも関わらず(5~15%くらい)、興味深いことに、PG合成を欠いたシアノバクテリア変異株は光合成活性を完全に失ってしまいます[17]。このことは、PGは光合成において必須の役割を果たしており、この機能はその他の糖脂質では補えないことを示しています。リン脂質の中で唯一PGのみが光合成膜構築に用いられているのは、このような理由からと考えられています。
(小林 康一 2011年3月)
引用文献
1. Awai, K. et al.. Comparative genomic analysis revealed a gene for monoglucosyldiacylglycerol synthase, an enzyme for photosynthetic membrane lipid synthesis in cyanobacteria. Plant Physiol 141, 1120-1127 (2006).
2. Shimojima, M. et al.. Cloning of the gene for monogalactosyldiacylglycerol synthase and its evolutionary origin. Proc Natl Acad Sci U S A 94, 333-337 (1997).
3. Kelly, A.A., Froehlich, J.E. & Dormann, P. Disruption of the two digalactosyldiacylglycerol synthase genes DGD1 and DGD2 in Arabidopsis reveals the existence of an additional enzyme of galactolipid synthesis. Plant Cell 15, 2694-2706 (2003).
4. Moellering, E.R., Muthan, B. & Benning, C. Freezing tolerance in plants requires lipid remodeling at the outer chloroplast membrane. Science 330, 226-228 (2010).
5. Awai, K. et al.. Two types of MGDG synthase genes, found widely in both 16:3 and 18:3 plants, differentially mediate galactolipid syntheses in photosynthetic and nonphotosynthetic tissues in Arabidopsis thaliana. Proc Natl Acad Sci U S A 98, 10960-10965 (2001).
6. Kobayashi, K., Awai, K., Takamiya, K. & Ohta, H. Arabidopsis type B monogalactosyldiacylglycerol synthase genes are expressed during pollen tube growth and induced by phosphate starvation. Plant Physiol 134, 640-648 (2004).
7. Nakamura, Y., Kobayashi, K. & Ohta, H. Activation of galactolipid biosynthesis in development of pistils and pollen tubes. Plant Physiol Biochem 47, 535-539 (2009).
8. Kobayashi, K., Kondo, M., Fukuda, H., Nishimura, M. & Ohta, H. Galactolipid synthesis in chloroplast inner envelope is essential for proper thylakoid biogenesis, photosynthesis, and embryogenesis. Proc Natl Acad Sci U S A 104, 17216-17221 (2007).
9. Kobayashi, K. et al.. Type-B monogalactosyldiacylglycerol synthases are involved in phosphate starvation-induced lipid remodeling, and are crucial for low-phosphate adaptation. Plant J 57, 322-331 (2009).
10. Jouhet, J. et al.. Phosphate deprivation induces transfer of DGDG galactolipid from chloroplast to mitochondria. J Cell Biol 167, 863-874 (2004).
11. Andersson, M.X., Stridh, M.H., Larsson, K.E., Liljenberg, C. & Sandelius, A.S. Phosphate-deficient oat replaces a major portion of the plasma membrane phospholipids with the galactolipid digalactosyldiacylglycerol. FEBS Lett 537, 128-132 (2003).
12. Narise, T. et al.. Involvement of auxin signaling mediated by IAA14 and ARF7/19 in membrane lipid remodeling during phosphate starvation. Plant Mol Biol 72, 533-544 (2010).
13. Kobayashi, K., Nakamura, Y. & Ohta, H. Type A and type B monogalactosyldiacylglycerol synthases are spatially and functionally separated in the plastids of higher plants. Plant Physiol Biochem 47, 518-525 (2009).
14. Garab, G., Lohner, K., Laggner, P. & Farkas, T. Self-regulation of the lipid content of membranes by non-bilayer lipids: a hypothesis. Trends Plant Sci 5, 489-494 (2000).
15. Simidjiev, I. et al.. Self-assembly of large, ordered lamellae from non-bilayer lipids and integral membrane proteins in vitro. Proc Natl Acad Sci U S A 97, 1473-1476 (2000).
16. Bjerrum, C.J. & Canfield, D.E. Ocean productivity before about 1.9 Gyr ago limited by phosphorus adsorption onto iron oxides. Nature 417, 159-162 (2002).
17. Sakurai, I. et al.. Requirement of phosphatidylglycerol for maintenance of photosynthetic machinery. Plant Physiol 133, 1376-1384 (2003).

 HOME
HOME Research
Research Diary
Diary